放开外商投资干细胞、基因诊断与治疗领域限制试点对我国CGT行业的影响分析
2024-09-06

9月8日,商务部、国家卫健委、国家药监局发布关于在医疗领域开展扩大开放试点工作的通知。明确自本通知印发之日起,在中国(北京)自由贸易试验区、中国(上海)自由贸易试验区、中国(广东)自由贸易试验区和海南自由贸易港允许外商投资企业从事人体干细胞、基因诊断与治疗技术开发和技术应用,以用于产品注册上市和生产。同时,拟允许在北京、天津、上海、南京、苏州、福州、广州、深圳和海南全岛设立外商独资医院(中医类除外,不含并购公立医院)。
笔者认为,通知的发布或将对我国CGT行业产生以下主要影响:
一、将进一步驱动国内干细胞分类分级监管机制的形成
通知明确本次外商投资限制放开的目的为“用于产品注册上市和生产”。但从实证角度,我国干细胞企业多呈现多业态特征。
加之本次拟允许在8个城市和海南全省设立外商独资医院。或可预见,国内干细胞行业的应用和监管将呈现更为复杂的局面。这也使得我国在干细胞领域建立分类分级机制变得更为紧迫。
因此,通知的发布将有利于推动我国从更高位阶构建干细胞领域“风险分级、监管分类”的整体监管机制。我们认为,我国对细胞治疗的监管大概率将出现如下变化或趋势:
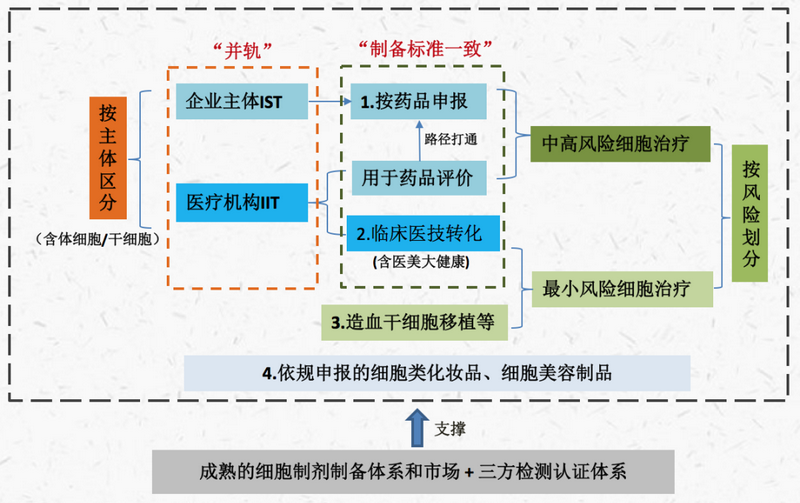
▲来源德恒律师整理
二、在学科交叉背景下,通知将进一步拓宽国内大量生物科技企业股权融资来源
近年来生物科技行业的发展呈现明显的学科交叉趋势,以干细胞为例,呈现从未修饰干细胞产品到基因修饰干细胞产品、从细胞产品本身到其衍生型相关产品、从“裸”干细胞产品到组织工程干细胞产品等特征。
在原外商投资目录下,国内大量生物科技企业在融资的时,因其技术模块涉及干细胞和基因编辑等,对接受包括港澳台资金在内的外资投资表现出一定的谨慎,通知的发布拓宽了上述企业的融资来源。
三、通知将给人遗监管内在机制和重点带来一定变化
(一)在“出海”背景下,CGT企业拟实现国际同步注册申报需要更为匹配的人遗监管机制
RDPAC发布的《中国全球同步研发生态报告》指出我国实现全球同步研发、注册、审评有早期加入全球同步、中后期研发同步、提早进行桥接和探索性临床试验等三种潜在路径。上述三种路径涉及的我国法律制度或机制主要如下:
上述报告也提到,在中美双报关键时间线对比中,人遗审批是导致国际多中心临床试验无法同步的主要影响因素之一。
本次通知明确,“拟进行试点的外商投资企业应遵守我国相关法律、行政法规等规定,符合人类遗传资源管理、药品临床试验(含国际多中心临床试验)、药品注册上市、药品生产、伦理审查等规定要求,并履行相关管理程序。”可以预见,外商限制放开后,对外商投资的CGT企业的人遗监管将进一步加强。因此拟实现我国CGT企业国际同步注册申报的目标,亟需更为匹配的人遗监管机制。
(二)按照2023年6月颁布的《人类遗传资源管理条例实施细则》的规定,外籍股东参股且 “实际控制“或“施加重大影响” 的外商投资企业,将被认定为“外方单位”,而外方单位不得在我国境内采集、保藏我国人类遗传资源。
实证情况是国内大量干细胞和基因治疗企业建有自己的物理样本库,部分企业涉及人遗资源采集。因此,后续在外商投资的CGT企业的人遗监管上,亟需形成更为明确的执行口径。
四、通知将进一步推动试点区域科技伦理审查工作的建设
2023年9月,十部委联合颁发《科技伦理审查办法(试行)》,对科研主体科技伦理审查等作出具体规定,并明确“从事生命科学、医学、人工智能等科技活动的单位,研究内容涉及科技伦理敏感领域的,应设立科技伦理(审查)委员会。”
按照上述规定,CGT领域当属应当设立科技伦理委员科技领域。可以预见,在通知明确要求拟进行试点的外商投资企业应遵守我国伦理审查规定、履行相关管理程序的情况下,上述区域在CGT领域的科技伦理管理工作将进一步补强。
整体上,本次放开外商限制的试点是对我国细胞与基因治疗领域及整个生物科技行业的一次重大利好。
本文作者:
声明:
本文由德恒律师事务所律师原创,仅代表作者本人观点,不得视为德恒律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容,请注明出处。
