正式施行!《人类遗传资源管理条例实施细则》要点解读
2023-07-10

人类遗传资源是生命科学研究的基础和先导,随着全球人类基因组研究的深入,人类遗传资源的研究开发与利用已经成为全球生物经济时代的核心技术之一,是国家发展生物产业的重要战略资源。自1998年国务院办公厅发布《人类遗传资源管理暂行办法》起,人类遗传资源已正式被列为我国生物资源重点保护对象。2019年,国务院出台《中华人民共和国人类遗传资源管理条例》(以下简称“《管理条例》”),结合我国对人类遗传资源研究与保护的需求,明确了我国人类遗传资源在采集、保藏、利用及对外提供的登记和管理规范。此后,我国逐步形成了以《管理条例》为核心,以科技部发布的各项指南及通知为补充的人类遗传资源监管体系。
2023年5月,科技部审议通过《人类遗传资源管理条例实施细则》(以下简称“《实施细则》”),对《管理条例》中的部分定义、监管要求作出进一步完善,明确了监管检查和处罚的规定,为各行业利用人类遗传资源开展活动提供了更为明确的指引。《实施细则》已于2023年7月1日正式实施,本文特此从规则定义清晰化、监管要求具体化、监管程序完善化三大方面对《实施细则》的重要革新进行分析与梳理,供各界人士参考。
一、规则定义清晰化
(一)细化“人类遗传资源信息”的定义
2019年发布的《管理条例》明确了人类遗传资源的范围主要为人类遗传资源材料和人类遗传资源信息。其中,人类遗传资源材料的定义为“含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料”,人类遗传资源信息的定义为“利用人类遗传资源材料产生的数据等信息资料”。该定义下,人类遗传资源信息的范围相对宽泛,仅明确了人类遗传资源信息的内涵,而未明确边界。
在《管理规则》实施过程中,该定义的周延性引发了较多疑问。监管部门发布的有关人类遗传资源采集、保藏、利用、对外提供的备案指南中,对于人类遗传资源信息的具体类型做了开放式列举,如临床数据、影像数据、生物标志物数据、基因数据、蛋白质数据和代谢数据等,该列举引发了更多对于“人类遗传资源信息”的争议。对此,科技部先后在《关于更新人类遗传资源管理常见问题解答的通知》(以下简称“《常见问题解答》”)、《关于更新人类遗传资源管理常见问题解答(系列问答二)的通知》(以下简称“《常见问题解答二》”)中回应了关于“心电图数据”、“临床图像数据”、“不涉及人群基因研究的临床数据”并不属于《管理条例》项下的“人类遗传资源信息”。
本次发布的《实施细则》在上述问答的基础上,进一步明确了该定义的外延,即“人类遗传资源信息”指利用人类遗传资源材料产生的人类基因、基因组数据等信息资料,同时临床数据、影像数据、蛋白质数据和代谢数据均不属于人类遗传资源信息。换言之,如果信息资料不涉及人类基因、基因组数据信息,或属于临床数据、影像数据、蛋白质数据和代谢数据则不受《管理条例》及《实施细则》管辖。

(二)确立“外方单位”的认定标准
《管理条例》对于外方单位的限制较为严格,即一方面将外方单位限定为“外国组织、个人及其设立或实际控制的机构”;另一方面禁止外方单位在境内采集、保藏、向境外提供人类遗传资源,仅允许其以与中方单位合作的方式利用我国人类遗传资源开展科学研究活动。
由于《管理条例》并未对“外方单位”的认定标准作进一步说明,长期以来实务中按严格标准将“外方单位”解读为包括境外主体直接或间接控股的或仅少量参股的主体,也包括无股权关系但被境外主体直接或间接协议控制的VIE公司。
《实施细则》从两个层面明确了“外方单位”的定义:
1.将“外方单位”的定义由“外国组织、个人及其设立或实际控制的机构”改为“境外组织、个人及其设立或实际控制的机构”,并从“实际控制”角度进一步细化规定了“境外组织、个人设立或者实际控制的机构”的判断标准,另外明确指出“设在港澳的内资实控机构视为中方单位”;
2.明确了“实际控制”的概念不仅限于持有表决权50%以上表决权,还包括通过其他方式代持或通过VIE结构施加影响力的情形。

《实施细则》对于“外方单位”定义的清晰化对内资实控的港澳企业、外资仅占少数比例的外商投资企业释放了利好信号,外资占比及表决权比例低于50%且不对企业的决策、管理进行支配或施加重大影响的企业,很可能可以根据相关规定在我国境内采集、保藏我国人类遗传资源。
二、监管要求具体化
(一)采集许可具体化
《管理条例》及《中国人类遗传资源采集审批行政许可事项服务指南》(“《采集服务指南》”)明确了需要遵循申报登记制度的人类遗传资源,即“采集我国重要遗传家系、特定地区人类遗传资源或者科技部规定种类、数量的人类遗传资源”需要向科技部申报登记,并取得采集行政许可。
《实施细则》从两个层面完善了上述规定,一方面明确了《管理条例》及《采集指南》中关于“重要遗传家系”及“特定地区人类遗传资源”的定义并细化了需要申请采集行政许可的情形;另一方面规定了两类豁免申请采集许可证的情形,即(1)为取得相关药品和医疗器械在我国上市许可的临床试验涉及的人类遗传资源采集活动无需申请采集许可;(2)申请人类遗传资源保藏活动同时涉及人类遗传资源采集的,仅需申请人类遗传资源保藏许可。具体规则对比如下:

(二)保藏许可具体化
在保藏行政许可层面,《实施细则》针对《管理条例》及《中国人类遗传资源保藏审批行政许可事项服务指南》(“《保藏指南》”)的规定进行了完善。首先明确了“保藏”与“临时储存”的区别,即“不包括以教学为目的、在实验室检测后按照法律法规要求或者临床研究方案约定的临时存储行为”,无须为此申请保藏行政许可。另外,《实施细则》第三十条对于人类遗传资源保藏的年度报告提出了具体的要求,并且规定科技行政部门应当对获批单位的保藏活动进行每年抽查。
(三)国际合作研究及对外提供的规则细化
1.放宽“外方单位”的伦理审查。
《管理条例》第二十二条要求外方单位利用我国人类遗传资源开展国际合作科学研究的,需要通过合作双方各自所在国(地区)的伦理审查,而《实施细则》为外方单位提供了所在国(地区)伦理审查的豁免可能。《实施细则》第三十一条规定 “外方单位确无法提供所在国(地区)伦理审查证明材料的,可以提交外方单位认可中方单位伦理审查意见的证明材料”。该豁免规定充分考虑了外方单位无法提供符合我国要求的所在国(地区)伦理审查材料的困境,解决了中外合作开展人类遗传资源国际研究的一大障碍。
2.细化国际合作备案的适用范围
《管理条例》第二十二条第二款规定了国际合作研究无需审批仅需备案的情形,即“为获得相关药品和医疗器械在我国上市许可,在临床机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源材料出境的,不需要审批。但是,合作双方在开展临床试验前应当将拟使用的人类遗传资源种类、数量及其用途向国务院科学技术行政部门备案”。《实施细则》第三十二条进一步限缩了仅需备案的范围,即无须申请国际科学研究合作行政许可的国际合作临床试验,应当符合下列情况之一,并在开展临床试验前将拟使用的人类遗传资源种类、数量及其用途向科技部备案:
(1)涉及的人类遗传资源采集、检测、分析和剩余人类遗传资源材料处理等在临床医疗卫生机构内进行;
(2)涉及的人类遗传资源在临床医疗卫生机构内采集,并由相关药品和医疗器械上市许可临床试验方案指定的境内单位进行检测、分析和剩余样本处理。
值得注意的是,上述国际合作临床试验所涉及的探索性研究部分,仍需要向科技部申请人类遗传资源国际科学研究合作行政许可。
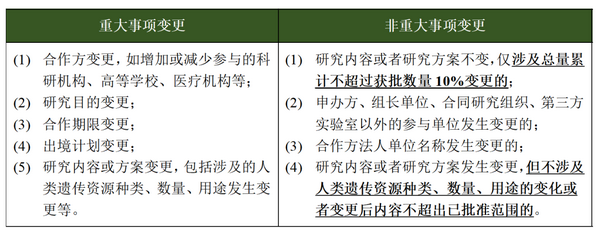
3.国际研究合作许可区分“重大变更”及“非重大变更”
《管理条例》第二十三条规定,国际合作科学研究过程中,合作方、研究目的、研究内容、合作期限等重大事项发生变更的,应当办理变更审批手续。《实施细则》在上述规定的基础上,进一步界定了“重大变更”的认定标准,并且明确“非重大变更”可不进行变更审批,仅向科技部提交事项变更的书面说明即可,进一步减轻了申请方的申报负担。
4.对外提供“备案”改“事先报告”
《实施细则》在《管理条例》的规则基础上,修改了关于对外提供人类遗传资源信息的管理方式,即从原有的“备案+信息备份”的模式改为了“事先报告+信息备份”的模式,并明确了事先报告的内容主要包括(1)对外提供的目的、用途;(2)对外提供的信息及信息备份情况;(3)接受单位的基本情况;(4)对外提供的潜在风险评估情况。
此外,《实施细则》规定,已经取得许可或备案的国际合作,就该合作产生的人类遗传资源信息,如国际合作协议中已约定由合作双方使用,则无须单独报告及提交信息备份,减轻了国际合作项目的备案和报告负担。
三、监管程序完善化
(一)简政放权,明确行政权责
《管理条例》第四条仅从地域管辖的角度划分了国务院与省、自治区、直辖市科学技术行政部门在人类遗传资源管理层面的权责,并未明确划分中央和地方在具体事项上的权责分配。《实施细则》通过不完全列举的形式在管理事项层面细化了中央与地方的权责分配。根据《实施细则》第三条,中央与地方的管理权限划分如下:
1.科技部:负责全国人类遗传资源调查、行政许可、监督检查、行政处罚等管理工作。主要开展人类遗传资源行政许可申请材料的形式审查、技术评审以及人类遗传资源备案、事先报告、监督检查、行政处罚等工作。
2.省级科技行政部门:本区域内的下列人类遗传资源管理工作,即
(1)人类遗传资源监督检查与日常管理;
(2)职权范围内的人类遗传资源违法案件调查处理;
(3)根据科技部委托,开展本区域人类遗传资源调查、人类遗传资源行政许可、人类遗传资源违法案件调查处理等工作。
(二)行政处罚标准明晰化
《实施细则》在行政处罚层面明确规定,科技部及省级科技行政部门将综合考虑违法行为的事实、性质、情节以及社会危害程度,合理确定行政处罚的种类与幅度,且后续科技部也将另行制定并公布人类遗传资源行政处罚的裁量基准,届时关于人类遗传资源的行政处罚标准会更加明晰。
结语
《实施细则》的出台对我国人类遗传资源管理体系的完善有重大影响,规则的细化与演进体现出了监管部门对人类遗传资源管理的思路——“简化审核流程,完善标准要求,明确处罚标准”。人类遗传资源的管理将影响包括但不限于医药、医疗器械、医疗机构、科研等多个行业,建议各界人士加以关注。
本文作者:

指导合伙人:

声明:
本文由德恒律师事务所律师原创,仅代表作者本人观点,不得视为德恒律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容,请注明出处。
