我国细胞行业当前业态、司法监管实践及未来监管模式研判报告
2023-05-30


当前我国细胞行业真实业态多样,细胞领域临床研究、研发、生产产能及市场需求均有较大释放空间;另一方面,从主要监管部门到各地地方政府,或在具体监管案例中谨慎处理,为日后完善监管留白预留充分政策空间,或积极探索细胞行业发展模式和监管路径。
本文拟通过全景梳理经市场化机制催生的细胞领域实际业态(而非从产业链角度),及各地司法、监管实践案例,并基于监管的底层逻辑和依托要素,分析研判我国细胞行业未来发展模式和监管路径,以供业界参考。除非明确写明“干细胞”或“免疫细胞”,本文所称“细胞”包含体细胞、免疫细胞、干细胞等。
一、我国细胞行业当前业态及典型投建模式
(一)当前细胞行业主要业态
根据市场公开信息,目前我国细胞行业主要业态包括细胞商业存储、细胞生产与制备、细胞医美大健康、按药物申报、双备案的干细胞临床试验、临床转化治疗等实际业态,整体如下图:
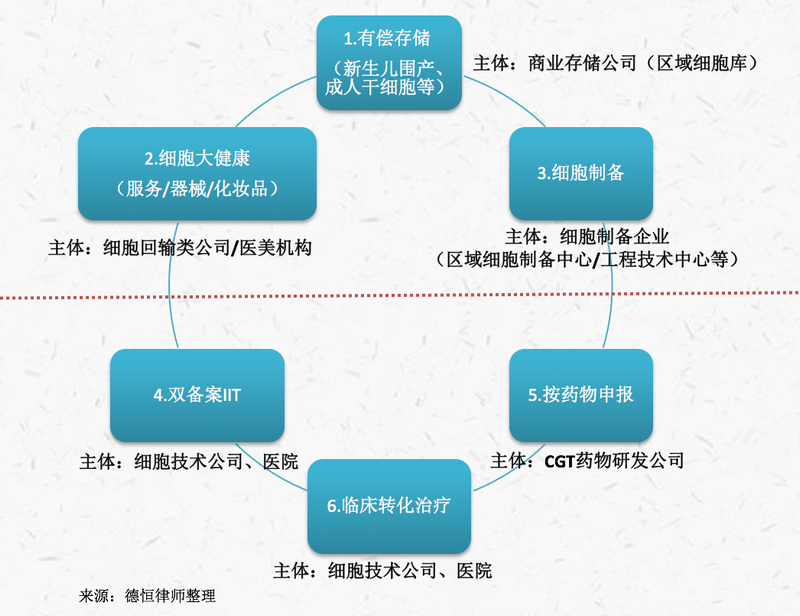
1.细胞商业存储现状
目前我国细胞存储业务分为公共血库造血干细胞存储和商业有偿存储,涉及的组织样本主要包括新生儿脐带、脐带血和胎盘样本、骨髓液样本、牙齿样本、脂肪组织、滑膜组织等。
公共库主要系原卫生部依据《脐带血造血干细胞库设置管理规范(试行)》等规定,以公益为目的进行采集和存储,供有需求的患者配型使用而先后批准设立的北京、天津、上海、浙江、山东、广东、四川等7个脐带血造血干细胞库。
商业存储则由相关企业面向社会公众从事有偿细胞存储和制备,以新生儿自体围产组织干细胞和成人自体细胞为主。目前各省基本均有细胞有偿存储业务业态,且呈现头部企业虹吸效应。如中源协和(600645)在2022年报中披露其已在全国20 个省市建立细胞资源库,开展脐带血造血干细胞、脐带间充质干细胞、胎盘亚全能干细胞、脂肪干细胞及免疫细胞的检测、制备与存储服务,构建了全国性细胞资源存储网络。
2.细胞生产与制备现状
除细胞药物研发制备企业及相关CDMO企业外,当前细胞制备业务主要指细胞企业为临床研究医院、科研及企事业单位提供细胞制品。如天晴股份(832035)年报披露,公司的制备服务项目“主要集中在省内及东三省的专业的肿瘤医院及综合性医院的肿瘤科、普通外科等产生肿瘤病人的科室,公司为他们的生物治疗癌症临床研究提供高效 NK细胞”。截止2022年底,我国获得中检院干细胞质量检验报告机构的数量约50家。近年,随着诱导多能干细胞(IPSC)技术及其应用的不断成熟和拓展,IPSC来源的种子细胞、前体细胞制剂制备的市场需求不断扩容。
在各地政府鼓励发展细胞与基因治疗背景下,头部细胞企业多被当地科技、发改等部门认定为当地“工程技术中心”、“工程研究中心”、“区域细胞制备中心”等。如赛莱拉(831049)曾在信披文件中披露,广东省(赛莱拉)区域细胞制备中心即是广东省发改委、省科技厅、省卫计委、省食药监局联合发函批复,由赛莱拉承担建设的省级区域细胞制备中心。
3.细胞医美与大健康业务现状
细胞大健康业务常见的有干细胞、免疫细胞回输及相关医美制品或服务。如冠昊生物(300238)在2021年报中即披露,公司“扎根大健康前沿领域,适时推出免疫增强方案、牙髓干细胞储存等新技术服务,借助产品线扩充升级,自建中医养生保健馆--天佑延年堂、高端综合门诊--广州百尼夫等技术落地运营机构,完善产品应用闭环”。
值得一提的是,由于人源细胞因子尚未列入国家药监局化妆品原料药目录,目前国内尚无获批的干细胞化妆品。国家药监局曾在2021年9月发文强调“干细胞化妆品”属于伪概念。当前合规化生产、销售的化妆品也并非是以“人源细胞”作为原料的化妆品。如赛莱拉曾披露“公司依托掌握的干细胞核心技术,延伸到动植物细胞提取物技术研发,将自主研发、自主生产的包含专利技术的动植物细胞提取物原料转化为功能性护肤品”。
4.按药物进行申报
随着2021年两款CAR-T产品在我国批准上市,细胞治疗产品按照药品监管的路径全面打通。根据CDE官网信息,截至2023年2月28日,国内共有42家企业的62款干细胞药物临床试验申请(IND)获得受理,30家企业的47款获得临床默示许可,主要为来源脐带、胎盘、骨髓、脂肪、牙髓、宫血等间充质干细胞药物。同时,IPSC类干细胞药物IND申请也逐渐增多。目前在该方面较活跃的企业包括安徽中盛溯源、南京艾尔普、浙江霍得生物、呈诺医学、武汉睿健医药等。
值得一提的是,今年4月西比曼生物科技正式宣布启动公司旗下“异体人源脂肪间充质祖细胞注射液AlloJoin”的 III 期临床试验。这也标志着我国干细胞药物研发进入III期临床时代。
5.双备案的临床试验现状
双备案即非注册临床研究(IIT)的研究机构、研究项目双备案。
经检索,目前全国已有137家研究机构(含军队医院22家)在卫健委、药监局或后勤保障部卫生局完成临床研究机构备案,共有112个干细胞临床研究项目备案。相关适应症涉及循环系统(如急性心梗、心衰)、神经系统(如帕金森病、缺血性卒中)、泌尿生殖系统(如宫颈粘连、卵巢早衰)、免疫系统(如狼疮性肾炎)、运动系统(如膝骨关节炎、半月板损伤等)等多系统疾病的治疗。
6.临床转化治疗现状
尽管监管政策前后有所变化,在医疗实践中,医院或企业通过多种方式尝试或实施细胞临床转化治疗的行为从未终止。许多地方政府或自贸区也积极探索,希望打通细胞临床转化治疗的支付路径。如中源协和在2021年报中披露,“2021 年 6 月,血研所与公司等主体合作建设中国(天津)自由贸易试验区联动创新示范基地,该基地计划依托国家干细胞工程产品产业化基地细胞存储、研发、生产制备、临床转化应用等全闭环管理环境,探索在细胞治疗临床试验同情用药、进口国外已上市国内未上市药品与医疗器械、细胞治疗按照医疗技术准入开展临床收费应用等方面实现突破”。
(二)当前细胞企业典型投建模式
鉴于细胞治疗药品研发周期长、资本密集的特点,国内多数细胞企业同时布局多种业态,以构建细胞产业全闭环。以国内上市或挂牌的细胞企业为例,其业态布局情况如下:

再如,根据市场公开资料,北京汉氏联合生物技术股份有限公司同时布局汉氏生物、汉氏药业、汉氏医学、希诺神州四个产业板块,其中汉氏生物负责细胞存储、制备和CXO服务;汉氏医学承担集团精准医疗大健康产业的建设运营任务,主要包括三级医院、综合门诊部、高端体检中心、第三方医学检验中心、互联网医院、医美护肤中心、医疗旅游等业务;汉氏医药则以细胞类新药研发为主,现有多个干细胞1类新药临床试验申请获得批准。
二、现有业态的法律评价与司法监管实践
(一)当前司法监管实践的整体特征
目前我国细胞领域的司法裁判以零星案例为主,尚未形成体系化的裁判标准,针对同类型案例,不同法院裁判口径不一;行政监管实践以相关主体投诉、举报等发起的被动型监管为主,主动研判型、体系化监管相对偏少。
值得一提的是,为应对行业发展带来的监管挑战,部分地方开始加强主动型监管的研究。如2021年9月深圳市坪山区人民法院发布《生物医药产业全流程法律风险及司法应对研究》专项调研课题投标公告,2022年12月深圳坪山区发布《深圳市坪山区生物医药企业刑事合规工作指引》,均系主动构建当地裁判或监管体系。
(二)各业态典型司法、监管案例及执行口径
1.商业存储业务的法律评价与裁判
(1)商业存储合约效力认定
泰州中院(2017)苏12民终570号一案中,在案由上,法院将脐带血存储纠纷界定为消费者权益纠纷;在合约效力上,针对上述人(存储脐带血的自然人)提出的“案涉合同违反法律、行政法规的强制性规定应当无效”的诉请,法院认为,上诉人 “既是脐带血造血干细胞的提供者,也是脐带血造血干细胞的所有者,脐带血造血干细胞仅仅供本人或者近亲属使用,并不涉及其他公民,亦不会对公共安全造成影响”,故“被上诉人接受上诉人委托制备、存储脐带血造血干细胞并不违反《中华人民共和国献血法》等法律、行政法规的强制性规定”,最终判决脐带血有偿存储合约有效。
经笔者在裁判文书网检索,尚未发现人遗条例颁布后的商业存储纠纷判例。
(2)商业存储与保藏审批的监管实践
目前的从事细胞商业存储的企业多将存储行为定位成基于“未来临床治疗目的”,未申请保藏许可。部分企业因兼有未来科学研究目的或承担了特定平台职能,则申请并获得了保藏审批,如河南省华隆生物技术有限公司河南省人类干细胞资源库等。
目前尚无商业存储方因未取得保藏许可而被人遗监管部门处罚的案例。
2.细胞回输协议效力的司法实践
在已有的细胞回输相关纠纷案例中,针对细胞回输协议的效力,出现“有效”和“无效”两种不同的裁判结果。
(1)协议有效的案例
在烟台中院(2020)鲁06民终1331号一案中,上述人(接受回输方)提出“被上诉人在未获得国家批准情况下,直接将‘干细胞回输液’注射到上诉人体内,并向上诉人收取费用,违反上述管理办法及《中华人民共和国药品管理法》、《医疗机构管理条例》等法律规定,被上诉人以‘免疫细胞保健’名义向上诉人有偿提供的‘干细胞套餐’服务依法应当认定无效。二审法院最终认为,“本案双方签订的‘干细胞套餐’服务合同,系双方真实意思表示,且双方在签订合同时,该合同并未违反法律或行政法规的强制性规定”,即判决细胞保健合同有效。
(2)协议无效的案例
在上海一中院(2020)沪01民终4321号一案中,法院认为 “与干细胞相关的管理规范具有公共利益属性,虽然《干细胞临床研究管理办法(试行)》不属于法律、行政法规,在法律规范的效力位阶上属于部门规章,但是该管理办法系依据《中华人民共和国药品管理法》《医疗机构管理条例》等法律、行政法规而制定,旨在规范和促进干细胞临床研究健康、有序发展”,因此,“聚仁公司销售‘干细胞’给他人直接用于人体回输,违反了《干细胞临床研究管理办法(试行)》第五十二条关于禁止干细胞直接进入临床应用的规定的同时,严重违背了伦理规范,破坏国家医疗监管制度,危及不特定个体生命健康安全,进而损害社会公共利益”,最终判决协议无效。
综上,对于细胞医美和细胞大健康服务的法律评价,司法实践中尚无统一认定标准。
3.“细胞化妆品”的监管实践
国家市场监督管理总局广告监督司《关于加强干细胞广告监管的工作提示》(广函字(2021)187号)、国家药监局《关于开展化妆品“线上净网、线下清源”专项行行动的通知》(国药监妆(2021)47号)等文件均明确不得违规宣称相关产品含有干细胞且存在美容、抗衰等功效,多地亦出现行政处罚案例。
因此,针对“细胞化妆品”的监管口径比较清晰。
4.临床转化治疗的司法监管实践
一直以来,国内因临床转化治疗涉刑案件较少,较有代表性的是(2020)沪0101刑初76号许某等人非法经营罪案。该案判决书载明,2016年12月至2017年4月期间,许某以上海某高校转化医学研究院名义对外招揽病患,汪某负责在涉案公司办公地制作干细胞注射液,最终在涉案医院肿瘤科或公司办公地为患有渐冻症、脑溢血等不同病症的患者有偿注射干细胞。
该案的审理过程颇有看点。最初,上海市黄浦区法院一审判决许某等人犯生产、销售假药罪,公诉机关及原审被告人均不服,分别提出抗诉、上诉。上海三中院以“涉案干细胞是否假药以及各被告人在共同犯罪中的地位、作用等事实尚需进一步查明”为由,裁定发回重审。2020年1月,黄浦区法院重审立案,黄浦区检察院变更指控罪名为非法经营罪。最终,黄浦区法院判决被告人许某等“违反国家药品专营、专卖管理法律法规,未经许可经营药品”,构成非法经营罪。许某的刑罚从生产销售假药罪项下的有期徒刑11年,变更为非法经营罪项下的有期徒刑6年。
同时,针对细胞临床转化治疗,近两年典型行政处罚案件如下:
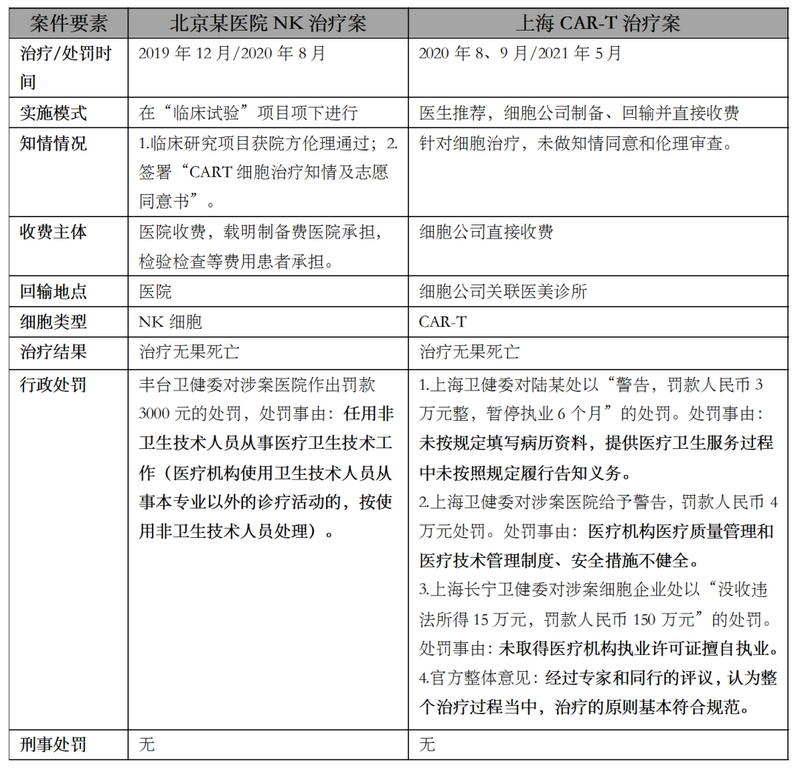
截止目前,上述案件相关方均未涉及刑事处罚。
5.与细胞领域相关的其他司法实践
目前与细胞行业关联的刑事罪名主要包括销售假药罪、诈骗罪以及走私、妨碍检验检疫等进出口类犯罪,其中以诈骗罪案例居首,这也与我国当前细胞治疗知识普及度和监管留白有关。近年来典型案件如下:
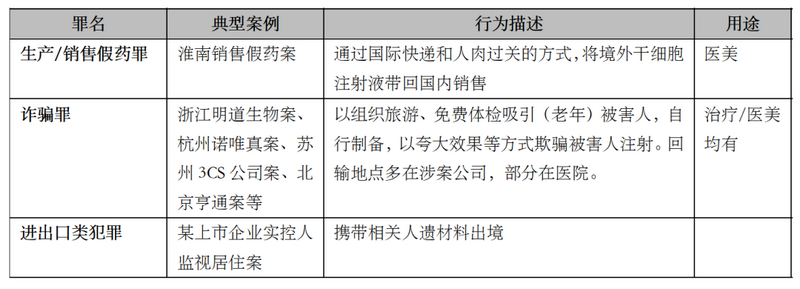
综上,尽管仅有少量司法裁判和监管处罚案例,但亦能看出,相关法院和监管部门在处理具体案件时,为行业发展预留政策空间的谨慎克制,在司法裁判上也似有轻刑化趋势。
三、我国细胞行业监管趋势研判与分析
(一)研判分析的基准
1.基于国外监管模式的共同底层逻辑或最大公约数
我们认为,无论是基于《公共卫生服务法案》将人体细胞和组织分为低风险产品(PHS ACT 351章节)和高风险产品(PHS ACT 361章节)而构建监管体系的美国“单轨制”(欧盟与之类似),还是将再生细胞治疗产品与药物、医疗器械平行立法的日本“双轨制”,均具有共性的底层逻辑和要素支撑。主要体现在以下两点:
(1)依托完善的风险分级制度
FDA依据细胞和组织产品风险的高低,将产品分为如下两大类,并明确界定“最小操作”和“同源性使用”的含义:
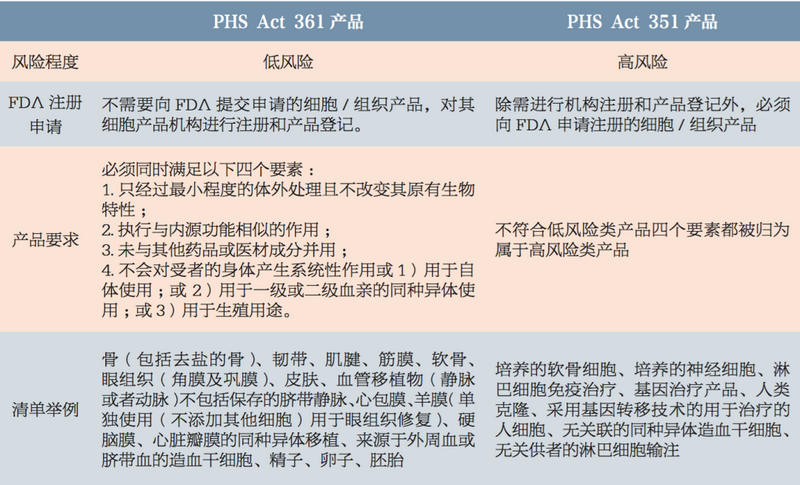
来源:《中国食品药品监管》
日本则由厚生劳动省(MHLW)按照三级风险对细胞治疗进行申报备案管理的,如下:
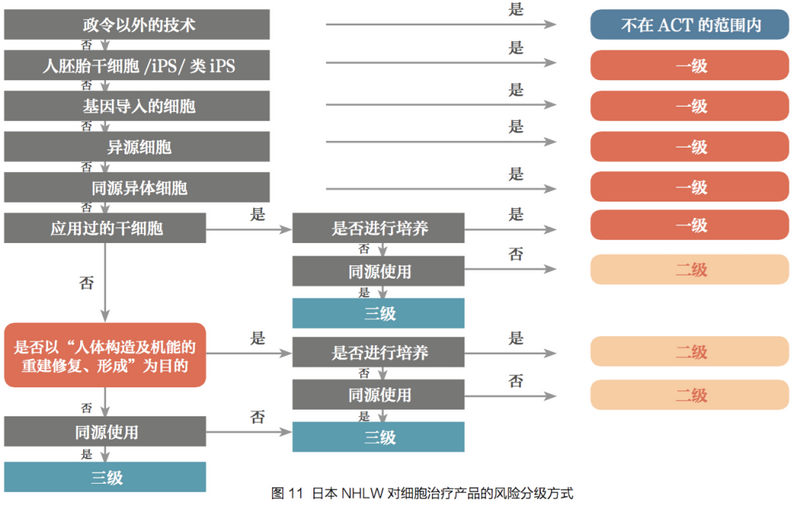
来源:《中国食品药品监管》
(2)依托完备的细胞制备体系和市场
针对细胞制备体系,美国FDA制定了较为完备的指南,包括工艺相关指南、临床前期相关指南、针对特定疾病或特定细胞的指南、有效性和安全性指南等。日本细胞治疗指导文件也涵盖不同的疾病领域、细胞类型,聚焦细胞采集、细胞制备、质量评价、疗效安全评估以及运输和存储标准等环节,基本实现细胞制备标准化。
关于细胞制备与流通市场,以干细胞为例,根据市场公开资料,日本在2020年底发放细胞制备许可证已超过2700家。
2.基于我国细胞行业监管模式的沿革逻辑
未来的监管模式即是对过去、当前现状的延伸和完善。
我国曾实行一段时间的“双轨制”,2016年“魏则西事件”之后,原国家卫计委终止细胞治疗收费,药监部门则逐渐强化、明晰和完善按药品监管的路径和体系。根据当前法律法规、规范体系,我国细胞基因治疗领域的“正清单”如下:
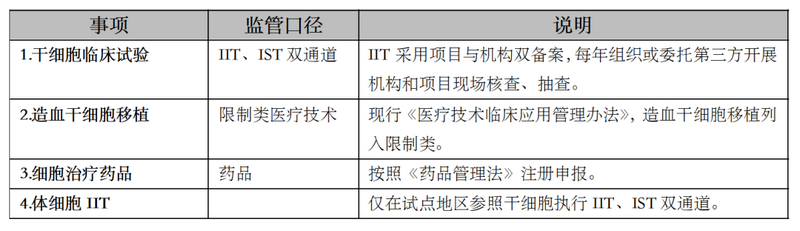
“正清单”之外领域的监管暂时留白,但趋势逻辑却在相关表征中有所体现。如2019年国家卫健委曾发布《生物医学新技术临床应用管理条例(征求意见稿)》《体细胞治疗临床研究和抓华应用管理办法(试行)》(征求意见稿),虽至今仍未颁布,但被业界认为是“双轨制”回归的信号。2023年5月9日卫健委发布的《体细胞临床研究工作指引(征求意见稿)》,即进一步体现了体细胞IIT与干细胞IIT监管模式逐渐趋同的趋势。
3.基于我国细胞领域政策趋势和立法逻辑
政策方面,继纳入十三五、十四五规划、健康中国 2030 后,2022年初,工信部、发改委、科技部、卫健委等九部门联合发布《“十四五”医药工业发展规划》,提出重点发展细胞治疗等新型生物药的产业化制备技术。2022年5月,发改委发布《“十四五”生物经济发展规划》,提出发展基因诊疗、干细胞治疗、免疫细胞治疗等新技术,加快相关技术产品转化和临床应用,推动形成再生医学和精准医学治疗新模式,并推动政策先行先试。
立法方面,我国在科技进步、生物安全、人遗资源管理、数据安全、科学伦理、外商投资、技术进出口等领域密集立法或修订,构建更符合当前国内外经济、科技发展形势的法律体系。
我们认为,我国针对细胞治疗等生物科技行业的政策和立法基本逻辑整体为“鼓励发展、守住红线”,具体如下:
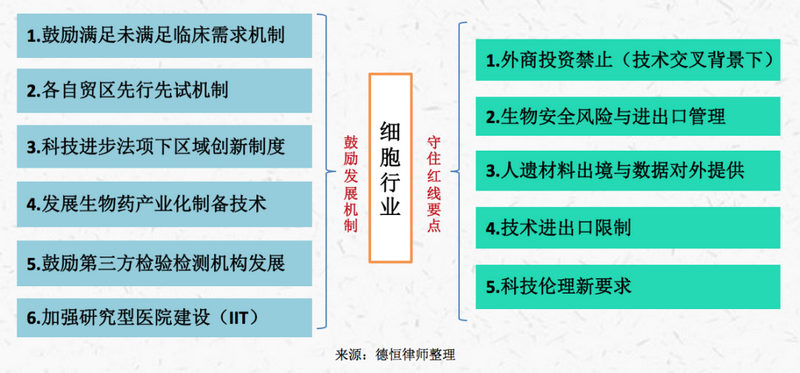
(二)监管趋势与中国版“双轨制”分析
1.商业存储的监管趋势分析
我们认为,一段时间内将商业存储自体库纳入保藏审批监管的可能性不大。对于“存储”行为,仍将根据“存储目的”进行区分监管,即仅对基于科学研究目的的样本库要求保藏资质,具体如下图:
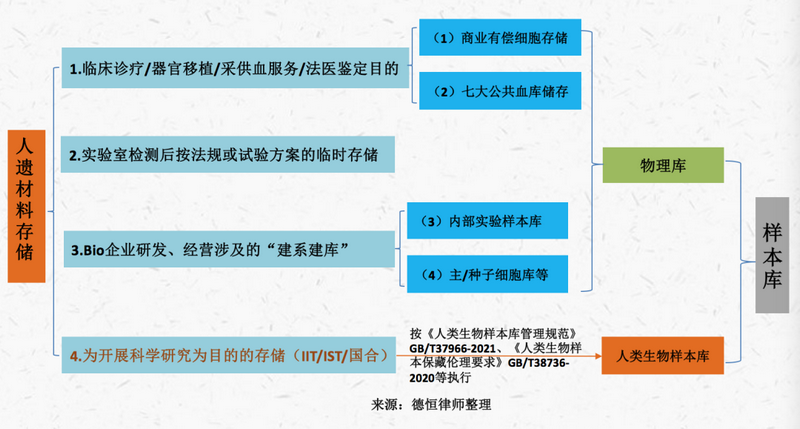
特别指出的是,无论是否取得保藏许可,从事干细胞存储的企业和机构均应无差别遵守《生物安全法》、人遗条例、《刑法》等法律法规中关于人遗资源出境、国际合作、人遗信息对外提供等监管的规定。
2.细胞医美与大健康的监管趋势分析
一方面,部分地方政府将干细胞医美作为地方特色经济来支持。如昆明市于2022年8月发布的《昆明市细胞产业发展规划(2021-2035年)》,在“近期重点推进”部分提出,“以临床技术(疾病治疗、医美应用)为行业突破点,打通临床应用环节和支付环节,实现临床技术在多病种上的突破”;在“重点任务”部分明确,“积极发展干细胞美容制品,引进一批拥有核心技术的医美制造企业;推进昆明医疗机构整形美容科室建设,推动干细胞研发等多方向研究及在修复重建、组织再生、创伤修复等的治疗应用;发挥昆明旅游胜地的流量优势,开发以干细胞医疗美容服务为主题的旅游产品”。
另一方面,2021年国家药监局修订发布的《已使用化妆品原料目录》中,并未收录“干细胞”作为化妆品原料。我国当前备案的干细胞临床研究中,也少有干细胞在美容、抗衰方面的研究。
我们认为,长远来看,细胞技术在医美和大健康领域的应用将分别纳入低风险临床转化细胞项目或保健品、化妆品等渠道监管。但因我国细胞制备体系和市场相对滞后、干细胞临床研究“双备案”门槛较高等现实因素,将“干细胞制品”纳入化妆品、保健品原料,或按照风险分级原则调整“双备案”门槛,在短期内落地的可能性不大,因此,未来一段时间内该领域大概率仍处于监管留白。但相关探索不会停止,如2021年1月,《中国美容整形外科杂志》即刊发《干细胞在整形修复美容领域研究和临床试验的专家共识》,旨在为干细胞在整形修复美容领域的研究与未来临床转化提供参考与支持。
3.细胞治疗的中国版“双轨制”模式分析
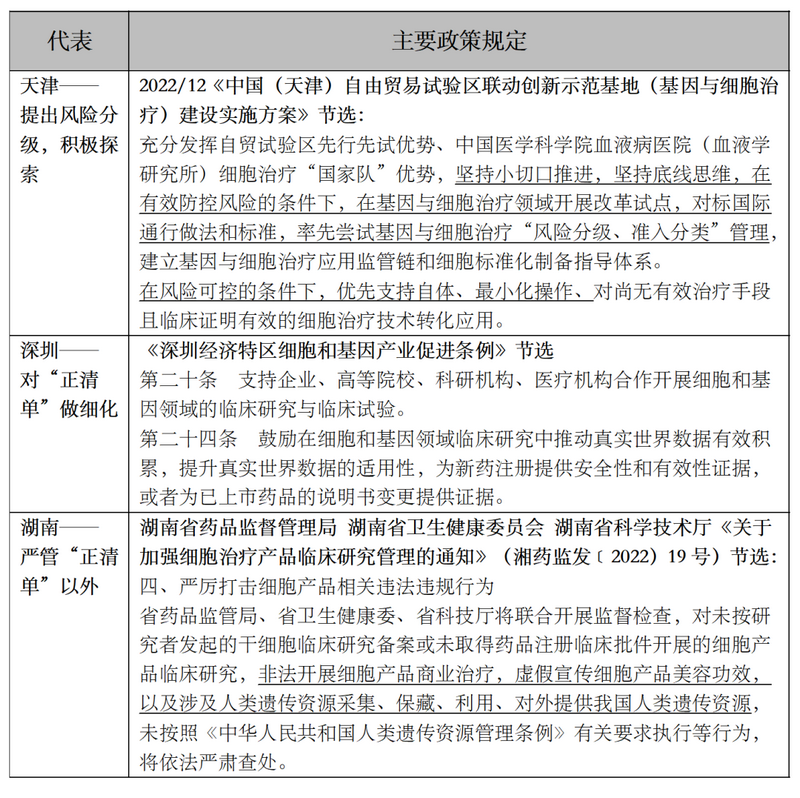
针对是否支持细胞治疗临床转化应用,不同地方政府表现出不同的态度,代表性的地方政策包括:
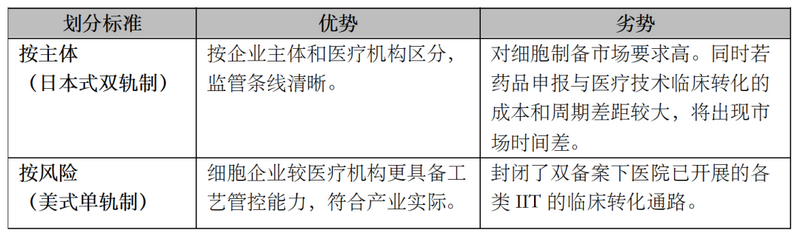
鉴于当前多数备案医院均不具备细胞制备能力,我国细胞制备工艺成熟度和市场容量也无法满足全面放开IIT项目临床转化的需求,因此完全按实施主体性质进行分类监管的可能性不大;同时,若仅依风险分级进行监管,将封闭现有多数“双备案”项目的临床转化通路,使得现有IIT研究的价值大打折扣,可行性亦受限。二种模式的优劣如下:
与之对应,我国细胞行业研发、生产产能和市场需求容量又亟需释放。
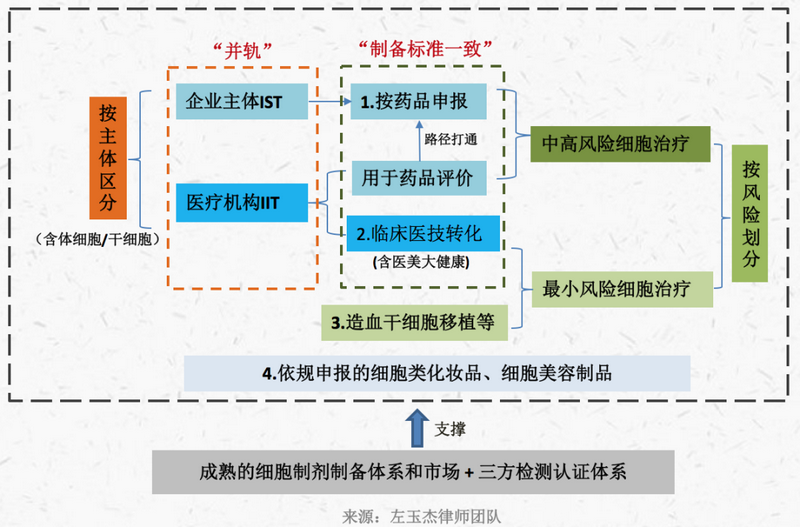
综上,我们认为,我国对细胞治疗的监管大概率将出现如下变化或趋势(各项内容或同步推进):
(1)对体细胞、干细胞临床研究的监管日渐趋同,即均施行“双备案”;
(2)率先在“双备案”项目中开展风险分级管理,并尝试放开低风险项目临床转化应用与收费;
(3)分类型、分病种完善细胞制备体系,统一或趋同不同监管通道的同类型细胞制备标准,扩容细胞制备市场和第三方检验检测市场;
(4)加强IIT与IST并轨管理,完善和优化IIT数据用于新药注册申请的路径和机制,进一步打通“双备案”项目成果转化通路;
(5)利用区域创新试点机制,择较成功区域扩大试点。
具体如下图:
结语:
尽管我国细胞行业的监管存在一定不确定性,但基于影响监管模式选择的底层逻辑和要素分析,我们仍能捕捉较多的确定性。对于不同的组织或机构,宜提前布局应对。如从事细胞医美的机构,积极推动细胞在美容、抗衰方面的IIT研究与转化,逐步将细胞医美大健康项目纳入各级、各类医疗机构经营范围,或是其合规化发展趋势。再如,对于地方政府,积极进行主动型管理布局,或是提高当地营商监管环境,促进当地细胞产业发展的有力措施。
参考文献:
[1]山东省烟台市中级人民法院(2020)鲁06民终1331号民事判决书;
[2]上海市第一中级人民法院(2020)沪01民终4321号民事判决书;
[3]江苏省泰州市中级人民法院(2017)苏12民终570号民事判决书;
[4]《注释刑法全书》陈兴著,2022版;
[5]《细胞和基因治疗产品监管科学研究进展和展望》,国家药品监督管理局药品审评中心高建超,韦薇,张旻,高晨燕,《中国新药杂志》2022年第31卷
[6]《国际细胞和基因治疗制品监管比较及对我国的启示》,虞淦军等,《中国食品药品监管》,2019年08期;
[7]冠昊生物科技股份有限公司2021、2022年度报告;
[8]中源协和细胞基因工程股份有限公司2021、2022年度报告;
[9]广州赛莱拉干细胞科技股份有限公司2021、2022年度报告;
[10]《诱导多能干细胞(IPSC)技术及转化、应用核心法律机制与问题研究》德恒律师,左玉杰等。
本文作者:
声明:
本文由德恒律师事务所律师原创,仅代表作者本人观点,不得视为德恒律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容,请注明出处。
