人遗资源监管机制对我国新药研发及国际同步注册、审评影响分析(上)
2022-03-29

前言:
本次《人类遗传资源管理条例实施细则(征求意见稿)》(以下简称:意见稿)的发布,使得我国人遗监管机制再度成为创新药领域讨论热点。本文拟结合意见稿规定,分析人遗监管机制对我国China alone、MRCT、License in、License out等不同新药研发模式的影响,供业界参考。
自《中国人类遗传资源管理条例》(以下简称:人遗条例)实施以来,业界关于提高人遗审批事项合理性、优化流程、提高监管透明度和审批时限可预测,以促进我国创新药研发尤其是参与全球同步研发的呼声一直不断。以中美早期临床为例,由下图可知,我国当前人遗监管政策已对临床项目周期的控制构成不利影响。
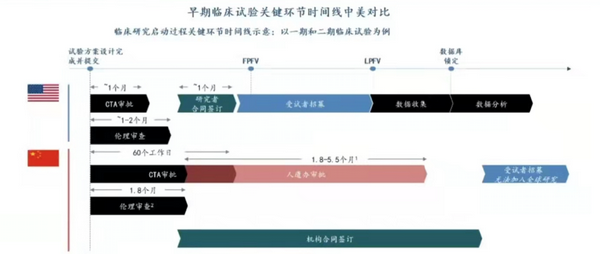
数据来源:RDPAC《中国全球同步研发生态报告》
一、不同新药研发模式中涉及的人遗监管问题
1.MRCT/全球同步研发、注册与审评
全球同步研发、注册与审评是推动我国创新药产业国际化发展的有效途径。RDPAC发布的《中国全球同步研发生态报告》指出我国实现全球同步研发、注册、审评有早期加入全球同步、中后期研发同步、提早进行桥接和探索性临床试验等三种潜在路径。
我们认为上述三种路径涉及的我国法律制度或机制如下:

从我国接受境外临床试验数据角度,上述不同路径对应如下具体情形:
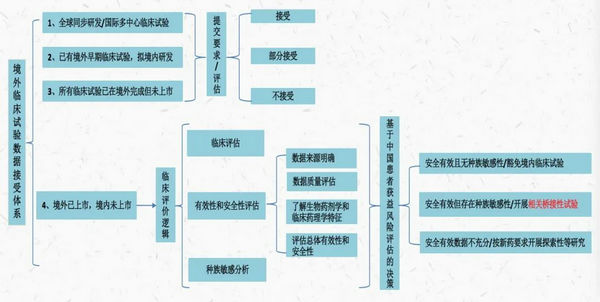
来源:德恒律师整理
2.license in/ license out涉及的人遗监管
近年国内药企研发质量渐获国际认可,我国创新药对外授权呈现量价齐升的态势。从交易主体看,更多国内药企参与其中,部分未盈利上市药企亦通过授权合作实现补流;被授权方也更加多元,形成跨国药企(以下简称:MNC)和区域性企业共同参与的局面。2021年license out 典型案例包括:
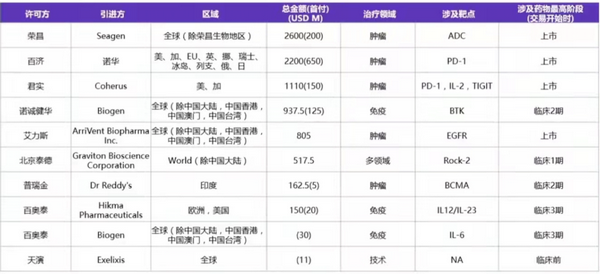
数据来源:科睿唯安
另一方面,随着国内Biotech公司不断增多、创新药政策法规利好等因素,License in交易也更为活跃。从项目阶段看,以中晚期项目为主,但早期项目开始增多;从交易形态上看,近2年再鼎、百济神州、信达生物、普方生物等创新药企业陆续引进技术平台合作。
我们认为,License in/ license out涉及的人遗监管问题如下:
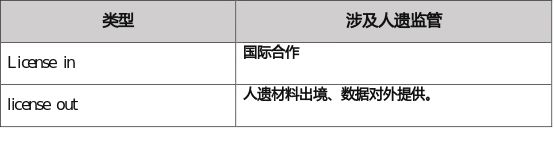
3.China alone 研发与临床试验
根据RDPAC的系列报告,我国临床资源和能力与美国相比,差距仍然较大。临床试验仍以China alone为主,具体如下:

来源:RDPAC
我们认为, China alone 研发中涉及人遗监管问题如下:

值得关注的是,本次意见稿进一步细化和明确了采集审批的范围,不再包含高血压、糖尿病等常见多基因疾病的人类遗传资源采集,以及为获得相关药品和医疗器械在我国上市许可的临床研究涉及的采集活动。
二、新药研发中核心人遗问题监管口径分析
(一)“外方单位”的界定及认定
本次意见稿明确了”外方单位“的具体标准,其第12条规定境外组织及境外组织、个人“实际控制情形”包括:(1)境外组织、个人持有或者间接持有机构50%以上的股份、股权、表决权、财产份额或者其他类似权益;(2)境外组织、个人持有或者间接持有机构的股份、股权、表决权、财产份额或者其他类似权益虽然未达到50%,但其所享有的决策机构表决权或其他权益足以对该机构的决议或对该机构的决策、内部管理产生重大影响;(3)境外组织、个人通过协议或者其他安排,足以对机构的决策、经营管理等重大事项施加重大影响;(4)科技部认定的其他情形。上述规定在实务涉及以下问题:
1.“外方单位”的认定标准与公司法、证券法规的勾稽
意见稿规定的“其所享有的决策机构表决权或其他权益足以对该机构的决议或对该机构的决策、内部管理产生重大影响”,在实务中或将造成执行口径不一的情形。
我们认为,此处关于“实际控制”和“重大影响”应当勾稽公司法和证券法规的相关规定,包括但不限于:
2.VIE认定为“外方单位”的影响分析
意见稿中 “境外组织、个人通过协议或其他安排,足以对机构的决策、经营管理等重大事项施加重大影响”当包含VIE情形,也即若本版意见稿最终实施,相关企业利用我国人遗资源开展研究,均需履行国际合作等审批程序。
以细胞与基因治疗领域为例,头部企业永泰生物、药明巨诺、亘喜生物、科济药业等均系通过VIE结构在境外(含香港)上市。如科济药业在其招股文件中针对VIE问题作出如下披露:“我们透过全资附属公司恺兴生命科技与科济生物、公司登记股东(即科济生物的股东)及个人登记股东(即公司登记股东的股东)订立合约安排”,“鉴于HGR条例缺乏明确的法律解释,倘若我们的VIE实体被相关政府主管部门认定为受限实体,我们的业务将受到不利影响,我们可能需要就目前的业务向相关政府主管部门获得批准,及/或与非HGR条例中受限实体的国内实体合作,并需要就该合作获得相关政府主管部门的批准或备案”。
综上,若搭建VIE结构的相关主体被最终认定为“外方单位”,将对我国现有人遗监管甚至资本市场监管业态均带来较大影响,对我国创新药出海和MRCT带来一定扰动。
3.实务中的“外方单位”认定责任主体
我们认为,实践中申报者、检验机构、CRO是否属于外方单位的认定责任,仍应由上述主体按照公司法等相关规定,向医疗机构提供证据材料及相关承诺,有医疗机构进行形式审查为宜。
(二)基于我国人遗资源的国际合作研发
意见稿规定了“国际合作要式协议”相关内容和机制,具体包括:

我们认为,上述规定确保了基于我国人遗资源的国际合作中中方的权益,但应兼顾促进国际合作、推动中国参与全球同步研发的激励机制的形成,如赋予合作双方一定的自主约定权。
(待续......)
本文作者:
声明:
本文由德恒律师事务所律师原创,仅代表作者本人观点,不得视为德恒律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容,请注明出处。
