内外有别 风险警觉——人类遗传资源管理常见误区和困惑解析
2021-01-20

立法背景
2019年7月1日,《人类遗传资源管理条例》(以下简称“《人遗条例》”)生效。
2020年10月17日,《生物安全法》正式通过(自2021年4月15日起施行),加强了对人类遗传资源的管理和监督。
2020年12月26日,《刑法修正案(十一)》(以下简称“《刑修十一》”)正式通过(自2021年3月1日起施行),新增了人类遗传资源相关犯罪。
2021年1月1日,《民法典》生效,对与人体临床试验、人体基因、人体胚胎等有关的医学和科研活动作出明确规定。
引言
随着生物安全被明确纳入国家安全监管体系,人类遗传资源(以下简称“人遗资源”)管理作为生物安全监管体系的重要一环受到广泛关注。近日有媒体报道,某港股上市的生物科技公司原董事长疑涉嫌走私人遗资源而被逮捕[1],引发行业热议。
实际上,人遗资源相关的业务场景复杂,实操中确实存在一些误区和困惑,例如回国创业的外籍科学家及其创立的生物医药企业是否需要进行人遗资源项目审批?科技部对于股权代持、员工持股平台、VIE等调整股权结构的方式持何种态度?人遗资源管理是否只针对外资不监管内资?
本文旨在梳理人遗资源管理对于外资和内资的不同监管要求和重点,针对常见误区和困惑进行讨论,厘清审批和备案路径,提示刑事合规风险,供生物医药企业及相关行业从业人员参考。因篇幅所限,人遗资源涉及的网络安全、数据合规和个人信息保护相关内容不在本文讨论范围内。
一、我国历来高度重视,近年执法力度加强
我国历来高度重视人遗资源的保护和利用工作,1998年出台的《人类遗传资源管理暂行办法》(以下简称“《人遗暂行办法》”)对于人遗资源的管理体制、开展国际合作和出境活动的审批程序均作出了规定。
2019年的《人遗条例》进一步明确采集、保藏、利用、对外提供我国人遗资源不得危害我国公众健康、国家安全和社会公共利益。《人遗条例》延续了《人遗暂行办法》的监管思路,明确了审批条件、完善了审批程序,禁止买卖人遗资源[2]。
需要明确的是,《人遗条例》审批、备案的监管要求,不适用于为临床诊疗、采供血服务、查处违法犯罪、兴奋剂检测和殡葬等活动需要而采集、保藏人遗资源及开展相应活动的情形。为临床诊疗、采供血服务等活动需要而采集、保藏人遗资源及开展相应活动,应当依照相关法律、行政法规规定执行。
此外,“材料归材料,数据归数据”的差异化管理也是一大亮点。根据《人遗条例》第二条,人遗资源包括人类遗传资源材料(以下简称“人遗材料”)和人类遗传资源信息(以下简称“人遗信息”),对两者进行区别管理。人遗材料是指含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料,人遗信息是指利用人遗材料产生的数据等信息资料。
相比《人遗暂行办法》,《人遗条例》的处罚力度明显增强。根据《人遗条例》第三十三条和第五章“法律责任”的规定,科技部和省级科技部门应当加强对人遗资源活动各环节的监督检查,对于违法的企业及相关责任人员(包括法定代表人、主要负责人、直接负责的主管人员以及其他责任人员)可能处以上至1000万元人民币或更高金额(5倍到10倍违法所得)的罚款和从业禁令。从业禁令可以同时适用于企业及相关责任人员,情节特别严重的,永久禁止其从事采集、保藏、利用、对外提供我国人遗资源的活动。
事实上,科技部于2020年开展了人遗资源管理的专项检查,检查范围覆盖开展涉及人遗资源相关活动的行为主体,重点检查对象包括曾受科技部行政处罚、开展活动较多和申报事项通过率较低的单位,以及2018年1-12月期间(《人遗条例》生效前)依据《人遗暂行办法》向科技部提交申请的相关单位[3]。值得注意的是,近日某知名美资药企因违规获得人遗相关行政许可,被罚停止受理其人遗资源国际合作活动申请六个月,处罚依据即为《人遗暂行办法》[4]。
二、对于“外方单位”的认定:严格口径
《生物安全法》和《人遗条例》对于外国组织及外国组织、个人设立或者实际控制的机构[5](以下简称“外方单位”)在中国境内开展人遗资源相关活动作出了严格限制,外方单位不得在我国境内采集、保藏我国人遗资源,不得向境外提供我国人遗资源[6],外方单位须以与我国科研机构、高等学校、医疗机构、企业(以下简称“中方单位”)进行国际合作的方式开展科学研究或临床试验[7]。
《人遗条例》下外方单位的概念,引起了生物医药行业的广泛关注和讨论。外资公司关注自己作为外方单位能做什么、不能做什么,是否能与境外总部进行人遗资源(尤其是人遗信息)共享,如何加快推进国际合作项目的审批或备案。而海外归国创业的科学家们,则为快速推进创业研究项目、融资、上市,竭力探寻避免被认定为外方单位的路径。
究竟该如何准确理解外方单位的定义?根据《人遗条例》第二十一条,外方单位是指“外国组织及外国组织、个人设立或者实际控制的机构”。港澳台组织及港澳台组织、个人设立或者实际控制的机构参照外方单位进行管理[8]。“设立”是否包括间接参股设立?“实际控制”该如何判断?从笔者了解到的情况来看,股权控制、协议控制或影响力控制(例如,通过一致行动协议控制表决权),均不排除被认定为“实际控制”、从而被进一步认定为外方单位的可能。
《人遗条例》下外方单位的概念有别于、并且广于《外商投资法》下的外商投资企业。根据《外商投资法》,外商投资企业是指 “全部或者部分由外国投资者投资,依照中国法律在中国境内经登记注册设立的企业”(以下简称“外商投资企业”)[9]。非在中国境内登记注册设立的企业或其他实体,例如国外的学术研究机构,虽不是外商投资企业,却属于外方单位的范畴。
实操中,科技部对外方单位的认定趋向严格。对于外资直接参股设立的外商投资企业,无论外资比例多少,均属于外方单位。对于外资间接参股的企业,包括层层向上穿透含有外资的国内企业,结合“实际控制”的标准,也可能被认定为外方单位。据此,外商投资企业境内再投资设立的国内企业(或称“内资企业”),以及外资通过VIE(Variable Interest Entities, 或称“可变利益实体”)协议控制的境内企业,均可能被认定为外方单位。
生物医药企业和创业人员往往陷入一种误区,认为可以通过股权结构的调整或者复杂的交易安排规避审批。例如,外籍回国创业的华人科学家和科研人员通过中国国籍的家人进行股权代持或者通过员工持股平台持有公司股权,或者通过VIE协议控制企业。
但是,这些方式有可能并不能避免企业被认定为外方单位。实操中,科技部会在企业注册申请账户时,就对企业的性质作出认定,然后方可开展具体的审批和备案申请。如果企业在注册时未根据科技部的要求依法披露信息,不排除在未来被追责的可能性。此外,由于股权结构不明晰,股权代持的安排本身可能对企业融资、甚至将来上市产生不利影响。
因此,外籍创业者和科研人员以及拟在境外资本市场上市的企业,涉及在境内开展人遗资源相关业务的,应当尤其关注外方单位的认定问题,以及在被认定为外方单位的情况下对业务开展有何潜在影响。
据悉,科技部正在就《人遗条例》制定实施细则及相关配套文件,我们期待实施细则对外方单位的认定问题作出进一步规定。
可以预见的是,人遗资源的监管将延续趋于严格的态势,并且短期内不会改变。生物安全已经上升到国家安全的新高度,因此企业必须重视人遗资源合规管理,避免触及生物安全和国家安全的红线。我们建议,可能被认定为外方单位的相关企业尽早向专业法律顾问和主管部门进行咨询,确定企业性质,并且结合自身情况进行审批和备案,以免影响自身业务的正常开展和投融资的进展。
三、对于国际合作两条路径的讨论
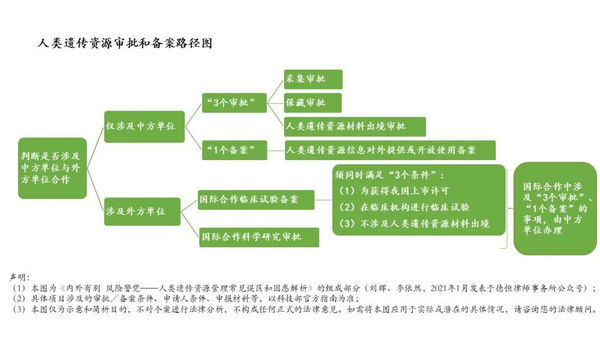
根据《人遗条例》第二十一条的规定,外方单位需利用我国人遗资源开展科学研究活动的,必须与中方单位(即我国科研机构、高等学校、医疗机构、企业)合作。国际合作项目可以从“国际合作科学研究审批”(以下简称“国际合作科研审批”)或者“国际合作临床试验备案”(以下简称“国际合作试验备案”)的两条路径中择一进行。需要注意的是,合作方包含参与项目的所有中方单位、外方单位,例如临床试验申办方、医疗机构(组长单位)、合同研究组织、第三方实验室,只要其中任何一方为外方单位,就必须选择国际合作的两条路径之一进行。
其中,根据《人遗条例》第二十二条的规定,对于同时符合以下三个条件的,进行国际合作试验备案即可,任何一个条件不符合的,进行国际合作科研审批:
条件一:目的为获得相关药品和医疗器械在国内的上市许可;
条件二:在临床机构利用我国人遗资源开展国际合作临床试验;
条件三:不涉及人遗材料出境。
对于条件二规定的“在临床机构”,科技部发布的《中国人类遗传资源国际合作临床试验备案范围和程序》中进一步释明了两种情况:
情况一:所涉及的人遗资源仅在临床机构内采集、检测、分析和剩余样本处理等;
情况二:所涉及的人遗资源在临床机构内采集,由临床机构委托的单位进行检测、分析和剩余样本处理等。
第二种情况下,必须由临床机构而非申办方或其他主体,与委托的单位签署正式协议并对其委托的活动负责。实操中,部分Ⅰ、II 、III期临床试验需进行国际合作科研审批而非国际合作试验备案,原因就是此类临床试验使用的是由申办方委托的实验室,而非由临床机构直接委托并签署委托协议,因此不符合情况二,不满足以上所述“在临床机构”的条件二。
需要特别注意的是,在国际合作的两条路径中,如果涉及采集、保藏人遗资源以及人遗材料的出境,仍然需要中方单位办理审批,涉及人遗信息对外提供或开放使用,仍然需要中方单位办理备案。从科技部官网公布的审批结果来看,采集、保藏人遗资源以及人遗材料的出境审批大部分由中方单位中的医疗机构取得,据了解,实操中人遗信息对外提供或开放使用的备案大部分也由医疗机构申请。
关于审批时限,从科技部官网公布的2020年审批和备案结果来看,在申请材料齐全的前提下,国际合作试验备案大约需要的时间为10到20个工作日,国际合作科研审批大约需要的时间为15到20个工作日。实践中,部分企业实际需要花费更久的时间准备申请材料。我们认为,要实现申请流程和时间可控可管理的目标,一方面有待《人遗条例》实施细则及相关配套文件的出台,另一方面,企业也需加强对科技部政策及其监管要求的理解,以尽早满足申请材料齐全的前提条件,顺利取得审批或备案。
笔者整理的人遗资源审批和备案路径图如下:
四、 “纯内资”无需任何审批或备案?非也!
《人遗条例》实施以来,很常见的一个误区就是所谓的“纯内资”企业在进行人遗资源相关活动时,无需进行任何审批和备案。需要强调的是,人遗资源管理并非只针对外方单位,中方单位亦受监管。
如上文所述,中方单位包括我国科研机构、高等学校、医疗机构、企业,“纯内资”企业应按照《人遗条例》的要求,依法进行人遗资源相关的审批和备案,否则可能面临行政处罚和刑事合规风险。为避免混淆,本文仅就性质为中方单位的“纯内资”企业进行讨论,“纯内资”企业不包括根据上文所述可能被认定为外方单位的内资企业。
根据《生物安全法》和《人遗条例》,采集、保藏人遗资源以及人遗材料的出境,必须以获得审批为前置条件,人遗信息对外提供或开放使用,则必须在完成备案后方可实施。前述审批或备案的申请主体为中方单位。如前所述,在“国际合作科研审批”或“国际合作试验备案”中,如果涉及采集、保藏人遗资源以及人遗材料的出境,或涉及人遗信息对外提供或开放使用,需要中方单位依法办理审批或备案。
五、人遗资源的采集和保藏
利用人遗资源开展临床试验、科学研究等活动,从项目全生命周期管理的角度来看,通常涉及人遗资源的采集、保藏、利用、共享或对外提供的四大环节。人遗资源的采集和保藏是开展业务的最前端,因此,企业应深刻理解与其相关的审批监管要求。
根据科技部发布的《中国人类遗传资源采集审批行政许可事项服务指南》,人遗资源采集审批适用于在中国境内从事的涉及重要遗传家系、特定地区人遗资源,以及规定种类(包括罕见病、具有显著性差异的特殊体质或生理特征的人群)、规定数量(即累积500 人以上)的人遗资源采集活动。生物医药企业应尤其注意,涉及规定种类的人遗资源采集,无论数量多少,均需要进行采集审批。对于并非涉及规定种类,但达到规定数量的人遗资源采集,也需要进行采集审批[10]。采集审批可能针对单独的采集事项,也可能针对科学研究或临床试验的采集环节,无论该等科学研究或临床试验由中方单位独立实施还是与外方单位合作进行。
根据科技部发布的《中国人类遗传资源保藏审批行政许可事项服务指南》,保藏是指将来源合法的人遗资源保存在适宜环境条件下,保证其质量和安全,用于未来科学研究的行为,不包括实验室检测后按照法律、法规要求或临床研究方案约定的临时存储行为[11]。人遗资源的保藏应符合《中国人类遗传资源保藏技术规范(试行)》等国家标准、行业技术规范。科技部已经审批通过的保藏项目有“上海长海医院生物样本库”[12]等。
保藏审批并非一劳永逸。中方单位在已获保藏审批后,利用之前保藏的人遗资源,与外方单位在后续开展合作,需根据具体情况,另行进行国际合作科研审批或者国际合作试验备案。
六、人遗资源的“对外提供”:材料和信息区别管理
许多生物医药企业对于人遗资源的对外提供和出境十分困惑,例如:对外提供的准确含义是什么?对外提供和出境有什么区别?如果涉及出境,到底申请审批还是备案?
如上文所述,人遗资源分为人遗材料和人遗信息,对于人遗材料和人遗信息是区别管理的,即“材料归材料,数据归数据”。
“对外提供”这个词,可以从广义上指人遗资源的对外提供,既包括人遗材料出境,也包括人遗信息对外提供或开放使用;也可以从狭义上指人遗信息的对外提供。需要注意的是,在《人遗条例》下,“出境”一词特指人遗材料出境,而向“外方单位”提供人遗信息即构成“对外提供”,对外提供人遗信息不以信息的“跨境”转移为前提。
明晰了以上几个概念,可进一步准确理解如下审批和备案要求:人遗材料出境需要审批,人遗信息的对外提供或开放使用需要备案。限于文章篇幅,本文仅讨论《人遗条例》项下对外提供人遗资源的要求,人遗信息出境可能涉及的网络安全、数据合规和个人信息保护要求不作讨论。
根据科技部发布的《中国人类遗传资源信息对外提供或开放使用备案范围和程序》,向外方单位提供或开放使用人遗信息,须由中方单位申请进行备案[13]。人遗信息的对外提供或开放使用,属于两种不同的业务场景。对外提供是向明确具体的外方单位提供,包括网络传输、实体存储介质或者其他形式,需明确对外提供的时间段、接收单位及其安全保护措施、信息的基本情况(类型/规格/检测单位等)、信息用途、存储方式、最终处置方式、可能存在的风险分析和对策等。开放使用是以特定方式公开人遗信息,包括论文发表、论著发表、信息平台共享、会议发布等方式。
需要注意的是,在中方单位作为申办方进行临床试验且不属于国际合作项目的情况下,如果临床试验电子数据管理系统(Electronic Data Capture,简称“EDC”)的供应商为外方单位,则该种情况仍被视为人遗信息的对外提供,需进行备案。
七、高度警觉人遗材料出境的刑事合规风险
对于人遗材料的出境,企业应该高度敏感和格外警觉。在科技部官网公布的行政处罚中,包括某公司在2016年未经许可将人遗资源的人血清作为犬血浆违规出境而被处罚一案[14]。前文提及近期某港股上市的生物科技公司原董事长被逮捕一案,媒体报道可能与人遗资源非法出境相关。
事实上,人遗材料的出境历来有法律法规的严格限制,并且,从《人遗暂行办法》到《人遗条例》,再到《生物安全法》和《刑修十一》,国家层面正在不断增强对于人遗材料出境的监管和法律责任。
《刑修十一》将自2021年3月1日起施行,其第三十八条明确规定了非法采集人遗资源或者人遗材料非法出境的刑事责任:“违反国家有关规定,非法采集我国人类遗传资源或者非法运送、邮寄、携带我国人类遗传资源材料出境,危害公众健康或者社会公共利益,情节严重的,处三年以下有期徒刑、拘役或者管制,并处或者单处罚金;情节特别严重的,处三年以上七年以下有期徒刑,并处罚金。”
在《刑修十一》之前,海关总署于2013年发文规定人遗资源属于《中华人民共和国限制进出境物品表》所列的“海关限制进境的其它物品”、“海关限制出境的其它物品”[15]。根据相关司法解释,未经许可进出口国家限制进出口的货物、物品,包括人遗材料出境,可能构成走私国家禁止进出口的货物、物品罪;已经取得许可,但超过许可数量,可能构成走私普通货物、物品罪[16]。
如相关项目涉及人遗材料出境,应严格遵照执行《人遗条例》的规定,依法办理出境审批,凭科技部出具的人类遗传资源材料出境证明办理海关手续。人遗材料的出境审批分为两种情况:国际合作科研审批,以及其他特殊情况确需将人遗材料运送、邮寄、携带出境的(以下简称“特殊情况人遗材料出境”)。根据《人遗条例》,对于国际合作科研审批中涉及人遗材料出境的,可以单独提出申请,也可以一并申请由科技部合并审批。对于特殊情况人遗材料出境的,企业也应当结合自身业务开展情况,根据科技部的官方指南,取得科技部出具的人类遗传资源材料出境证明[17] 。
由于人遗材料出境这一事项的高度敏感性,我们建议相关企业对可能涉及人遗材料出境的项目,包括过往的、正在进行中的和未来计划开展的,进行全面的梳理和排查,对可能存在的问题及时整改,与监管部门保持沟通,避免对后续业务开展产生不利影响。
结束语
综上,人遗资源管理历来受到高度重视,在生物安全监管体系不断加强的大背景下,可以预见科技部、海关、公安等部门的执法力度将会进一步加强。企业开展涉及人遗资源的采集、保藏、利用、对外提供等相关活动时,生物安全和国家安全是不可触碰的红线。在人遗资源管理的思路中,外方单位和中方单位(包括“纯内资”企业)均受到相关监管,并且监管的要求和重点不尽相同。相关企业应当根据自身情况和业务场景,按照《人遗条例》和科技部的相关官方指南,办理审批和备案,并且高度警觉人遗材料出境的刑事合规风险。
我们建议,企业应当与专业法律顾问和监管部门明确企业的性质和对应的审批、备案项目,建立和完善人遗资源管理的合规体系,针对业务场景中可能涉及的人遗资源相关的环节,进行系统梳理和定期自查,并且持续关注人遗资源管理的最新政策法规和执法动态,为业务的健康持续开展保驾护航。
文中备注:
[1]《生物安全第一案!金斯瑞原董事长疑涉走私人类遗传资源》,载凤凰网财经,2020年11月23日,网址:http://finance.ifeng.com/c/81djlNUfn5F,2021年1月7日访问。
[2]司法部、科技部负责人就《中华人民共和国人类遗传资源管理条例》答记者问,载司法部官网,2020年6月11日,网址:http://www.gov.cn/zhengce/2019-06/11/content_5399059.htm,2021年1月7日访问。
[3]《科技部办公厅关于开展全国人类遗传资源行政许可管理专项检查有关工作的通知》,载科技部官网,2019年12月30日,网址:https://fuwu.most.gov.cn/html/tztg/qt/20191230/123123237.html,2021年1月7日访问。
[4]行政处罚决定书国科罚〔2020〕2号,载科技部官网,2020年12月20日,网址:https://fuwu.most.gov.cn/html/tztg/xzxkzx/20201220/123123683.html,2021年1月7日访问。
[5]参见《人类遗传资源管理条例》第21条。
[6]参见《生物安全法》第56条第4款和《人类遗传资源管理条例》第7条。
[7]参见《生物安全法》第56条、59条和《人类遗传资源管理条例》第21条、22条。
[8]参见科技部发布的《中国人类遗传资源国际合作科学研究审批行政许可事项服务指南》第7条。
[9]参见《外商投资法》第2条。
[10]参见科技部发布的《中国人类遗传资源采集审批行政许可事项服务指南》第1条。
[11]参见科技部发布的《中国人类遗传资源保藏审批行政许可事项服务指南》第1条。
[12]《中国人类遗传资源行政许可事项2020年 第十八批审批结果》,载科技部官网,2020年9月22日,网址:https://fuwu.most.gov.cn/html/tztg/xzxkzx/20200922/123123445.html,2021年1月7日访问。
[13]参见科技部发布的《中国人类遗传资源信息对外提供或开放使用备案范围和程序》第1条。
[14]《药明康德等公司接“罚单” 人类遗传资源管理收紧》,载新浪财经,2018年11月10日,网址:https://finance.sina.com.cn/roll/2018-11-10/doc-ihnstwwp9264307.shtml,2021年1月7日访问。
[15]参见《海关总署公告2013年第46号关于<中华人民共和国禁止进出境物品表>和<中华人民共和国限制进出境物品表>有关问题解释的公告》第2条和第3条。
[16]参见《最高人民法院、最高人民检察院关于办理走私刑事案件适用法律若干问题的解释》第21条。
[17]参见《人类遗传资源管理条例》第27条。
本文作者:
刘辉,德恒上海办公室合伙人、律师。刘辉律师专注于医疗健康产业领域,并有丰富的行业实务经验,业务领域包括投资并购、整合、业务剥离、争议解决、危机管理、一般性公司事务、医疗保健合规(市场监管合规、反贿赂、反垄断、反不正当竞争、促销与广告合规、数据合规与个人信息保护等)。
邮箱:sanny.liu@dehenglaw.com
(实习生俞雪薇对本文亦有贡献)
声明:
本文由德恒律师事务所律师原创,仅代表作者本人观点,不得视为德恒律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容,请注明出处。
